標準品事業について
標準品製造機関として
一般財団法人医薬品医療機器レギュラトリーサイエンス財団は、日本薬局方標準品を製造する者の登録に関する省令(平成19年厚生労働省令第117号)に基づき日本薬局方標準品を製造する機関として厚生労働大臣の登録を受け、医薬品の品質試験に用いられる標準品を製造・頒布しています。
更に、タール色素省令薄層クロマトグラフ用標準品(*1)及び食品添加物公定書標準品(*2)の製造機関としてもそれぞれ厚生労働大臣、内閣総理大臣の登録を受け、それらの標準品の製造・頒布も行っています。
これらの標準品は、日本薬局方などの公定規格書に規定されている各種の試験に用いられ、試験の信頼性や客観性の保証基盤として、わが国の医薬品等の品質の確保及び向上に寄与しています。
(*1) 薄層クロマトグラフ用標準品を製造する者の登録に関する省令(平成16年厚生労働省令第86号)
(*2) 添加物に係る標準品を製造する者の登録に関する規程(平成16年厚生労働省告示第219号)
この標準品事業を担当している医薬標準品センターでは、厚生労働省から指示を受けた標準品を製造し、頒布するにあたり、下図に示したプロセスを確実に実施して標準品の品質確保及び安定供給に努めています。
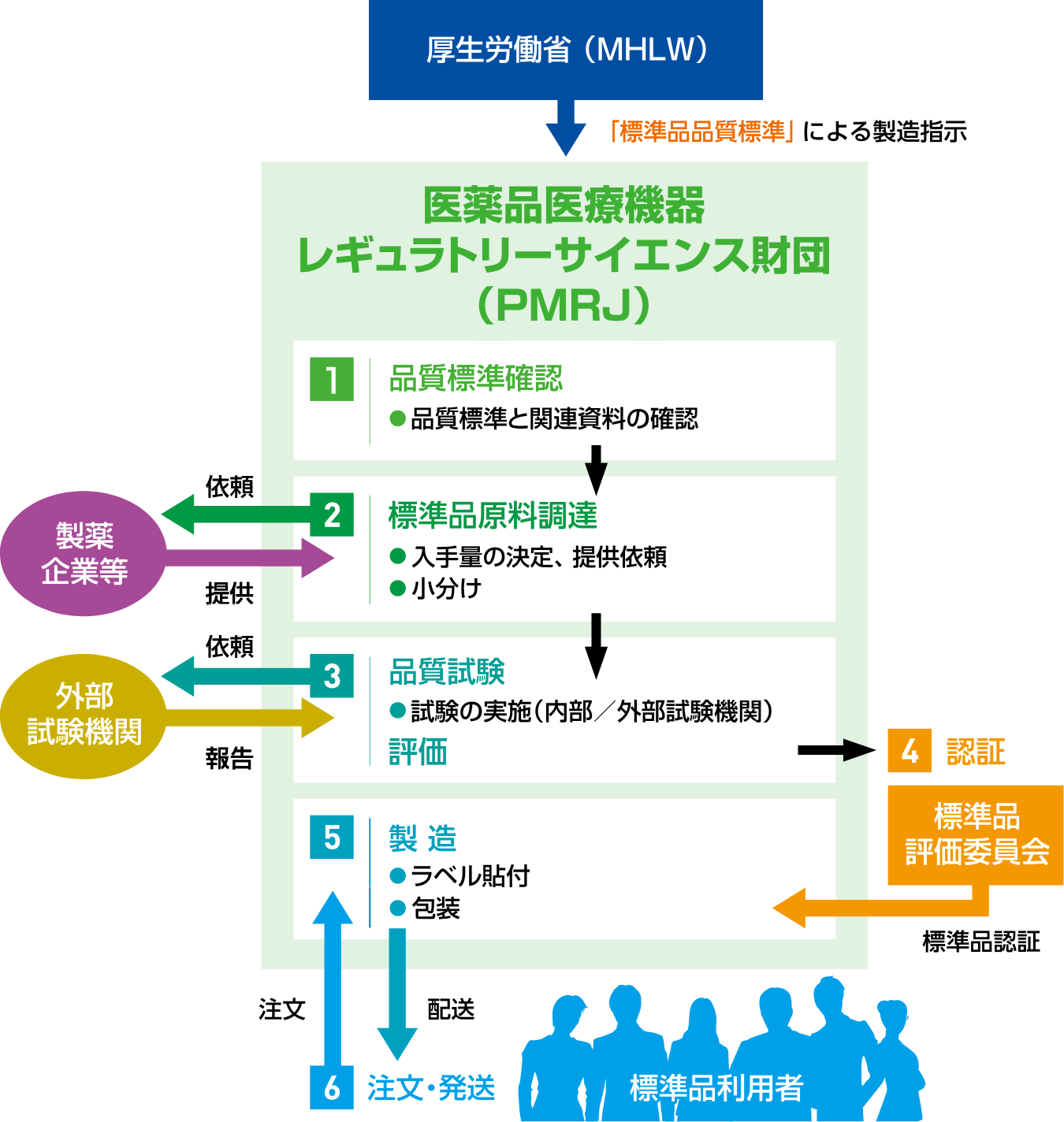
日本薬局方標準品の製造にあたっては、標準品として相応しい品質の原料を入手することが極めて重要です。入手した原料は標準品候補品として、当部及び外部試験機関において品質試験を実施します。
原料をご提供頂いたメーカーに深く感謝すると共に、第14改正日本薬局方以降、当財団(登録製造機関)が製造する標準品の原料をご提供頂きましたメーカー名を公表させていただきます。
また、独立行政法人医薬品医療機器総合機構(PMDA)の日本薬局方原案検討委員会に準委員として、標準品の品質確保と適正利用等の審議に参画するとともに、新たなカテゴリーの標準品の設定・製造・頒布にも積極的に取り組んでいます。さらに、欧米の薬局方標準品製造機関との交流や標準品関連の国際シンポジウム等への参加を通して国際動向の把握に努め、また国際規格ISO/IEC 17025の試験所認定の取得や技能試験に参加するなど、技術レベルの向上と体制の強化に取り組んでいます(品質保証について)。
米国薬局方(USP)標準品などの取次販売
米国薬局方協会(USP Convention)との契約により、日本国内向けに米国薬局方(USP)標準品の取次販売を行っています。また、ドイツのLGC Standards 社の扱う医薬品不純物の標準物質等の取次販売、ならびに同社を通した欧州薬局方(EP)標準品、英国薬局方(BP)標準品、およびWHO ICRS(国際化学薬品標準品)の取次販売も行っています。
技術情報の提供
当財団の研修事業の一環として、薬局方利用者や標準品利用者を対象に、エンドトキシン試験法など、薬局方の一般試験法を中心に、実務レベルでの技術情報の普及と技術交流を目的とする少人数での技術研修会を医薬標準品センター内において開催しています(日本薬局方に関する技術研修会シリーズ)。